In der häuslichen Beatmungstherapie ist eine Befeuchtung der Atemluft mit vielen Vorteilen verbunden. Bei der Maskenbeatmung, sei es nun bei obstruktiver Schlafapnoe mit CPAP oder bei der häuslichen Beatmung infolge hyperkapnischer Insuffizienz, kommt es mehr oder weniger häufig zu Leckagen durch Undichtigkeiten an der Maske.
Bei Nasenmasken kann es durch die Mundöffnung zu einem erheblichen Leckagefluss durch die Nasenschleimhaut kommen, der zu deutlicher Austrocknung führt. Allerdings ist das auch bei Einsatz von Nasen-Mund-Masken nicht gänzlich zu vermeiden. Besonders nachts bei Lageänderung im Schlaf kommt es bei Undichtigkeiten zum erhöhten Fluss aus dem Beatmungsgerät, das damit versucht, den Druck aufrecht zu erhalten. Dabei kann es auch passieren, dass die Nasenpassage unnötigerweise bei geöffnetem Mund durchlaufen wird. Das fördert die Austrocknung ebenfalls.
Folgerichtig haben entsprechende Studien auch gezeigt, dass eine Befeuchtung bei der häuslichen Beatmungstherapie mitunter die Adhärenz erhöht, weil sich die Nebenwirkungen hierdurch verringern lassen (1, 2, 3, 4).
Bei Patienten, die über einen Tubus zu Hause beatmet werden, ist eine ausreichende Befeuchtung noch wichtiger, denn hier fällt die natürliche Anfeuchtung durch die Nasenscheidewand ganz weg.
Nun gibt es immer wieder Diskussionen zur hygienischen Sicherheit der verschiedenen, auf dem Markt angebotenen Befeuchtungsgeräte. Um diese spezifische Hygienesituation zu verstehen, muss man etwas zum physikalischen Hintergrund der Befeuchtung erklären. Dann wird unmittelbar klar, dass hier eine ganz andere Situation vorliegt im Vergleich zu vielen anderen Hygieneproblemen.
Ziel der Befeuchtung ist es, den Wasserdampfgehalt in der Inspirationsluft anzuheben. Allgemein gilt, dass die Luft umso mehr Wasser tragen kann, je wärmer sie ist. So enthält mit 100 % gesättigte Luft bei 20 °C ca. 20 mg Wasser pro Liter. Wasserdampf selbst ist ein Gas, das man nicht sieht. Nimmt die Temperatur ab, so kann die Luft weniger Wasserdampf tragen, vereinfacht bei 10 °C nur noch die Hälfte, also ca. 10 mg.
Weiterhin ist von Bedeutung, dass man den Wasserdampf erst dann (indirekt) erkennt, wenn die Luft sich abkühlt. Der Wasserdampf kondensiert dann zu Tröpfchen, was sich als Nebel oder Niederschlag an Oberflächen (z. B. Fensterscheibe) zeigt.
Hier ist auch unmittelbar verständlich, dass ein Anheizen der Befeuchtungssysteme sinnvoll ist, denn ein Leckagefluss bei undichter Maske kann schnell 20 bis 40 Liter pro Minute erreichen (4). Um hier noch eine natürliche Befeuchtung zu erhalten, sind größere Mengen Wasserdampf erforderlich.
Normalerweise hat eine Raumtemperatur von 20 °C eine Feuchte zwischen 30 % und 60 %. Das hängt sehr von der Außentemperatur ab. An kalten, klaren Wintertagen, ist die Feuchte der Außenluft oft bei 70–80 %. Wegen der Kälte ist aber die enthaltene Wassermenge gering. In der warmen Wohnung sinkt dann die Feuchte entsprechend, sodass im Winter oft über trockene Schleimhäute geklagt wird. Entsprechend größer sind auch die Probleme in der häuslichen Beatmungstherapie im Winter. Im Sommer kann manchmal sogar ein Zuviel an Befeuchtung zu Kondensation im Schlauch und zu Wasseransammlung führen. Dann muss man die Befeuchtung abstellen bzw. die Temperatur herunterdrehen.
Wasserdampf selbst ist ein reines Gas, das keine Partikel oder Aerosole enthält. Verfügt man beispielsweise über eine Salzlösung benutzt man dazu die Destillation. Man erhitzt die Lösung und kühlt den Wasserdampf wieder ab. Es resultiert destilliertes Wasser, das im Idealfall keine Fremdstoffe enthält, natürlich auch nicht das Salz. Allerdings gibt es Ausnahmen. Mitunter können leicht flüssige Stoffe bei der Temperaturerhöhung mitverdampfen, sodass sie dann ebenfalls ein Gas bilden. Dieses ist bestens bekannt durch ein Kamillendampfbad. Hier entsteht auch nur Wasserdampf. Die ätherischen Öle in der Kamille haben aber einen niedrigen Siedepunkt, sodass sie mit dem Wasserdampf in die Gasphase übergehen, was man dann entsprechend riechen kann.
Obwohl das physikalisch unmittelbar einleuchtend ist, werden hier häufig Fehler gemacht. Ich habe selbst nicht selten auch in Kliniken erlebt, dass man in sogenannten Bronchitiskesseln, die zur Befeuchtung der Atemluft dienten, Medikamente z. B. zur Bronchialerweiterung hineingegeben hat, in der Meinung, dass diese den Atemtrakt des Patienten erreichen. Diese bleiben natürlich, wie Kochsalz, in der wässrigen Lösung und gehen nicht in die Dampfphase über.
Übertragen auf die hygienische Frage gilt dies dann naturgemäß auch für Mikroorganismen wie Bakterien, die durchaus das Wasser in den Befeuchtersystemen kontaminieren können. Sie verbleiben aber in der Lösung und gehen nicht in den Wasserdampf über.
Anders ist die Situation bei Verneblern, die dazu dienen, Medikamente in das Bronchialsystem bzw. die Lunge zu transportieren. Solche Verneblersysteme erzeugen Tröpfchen aus der Verneblerflüssigkeit, wozu eine bestimmte Energiemenge erforderlich ist. Hier gibt es unterschiedliche Prinzipien: die bekanntesten sind der Pressluft-Düsenvernebler, Ultraschallsysteme oder schwingende Membranen. Abb. 1 zeigt einen typischen pressluftgetriebenen Düsenvernebler. Bei der Verneblung ist es das Ziel, Medikamente, die in der Verneblerflüssigkeit (meistens wässrige Lösung) enthalten sind, über die Tröpfchen an den Ort der Therapie, meist Nase oder Bronchialsystem, zu transportieren. Die Tröpfchen haben die gleiche Zusammensetzung wie die Verneblerflüssigkeit. Ist jetzt die Verneblerflüssigkeit zum Beispiel mit Bakterien kontaminiert, so sind diese auch in den Tröpfchen enthalten und können unter Umständen zu Infektionen führen.
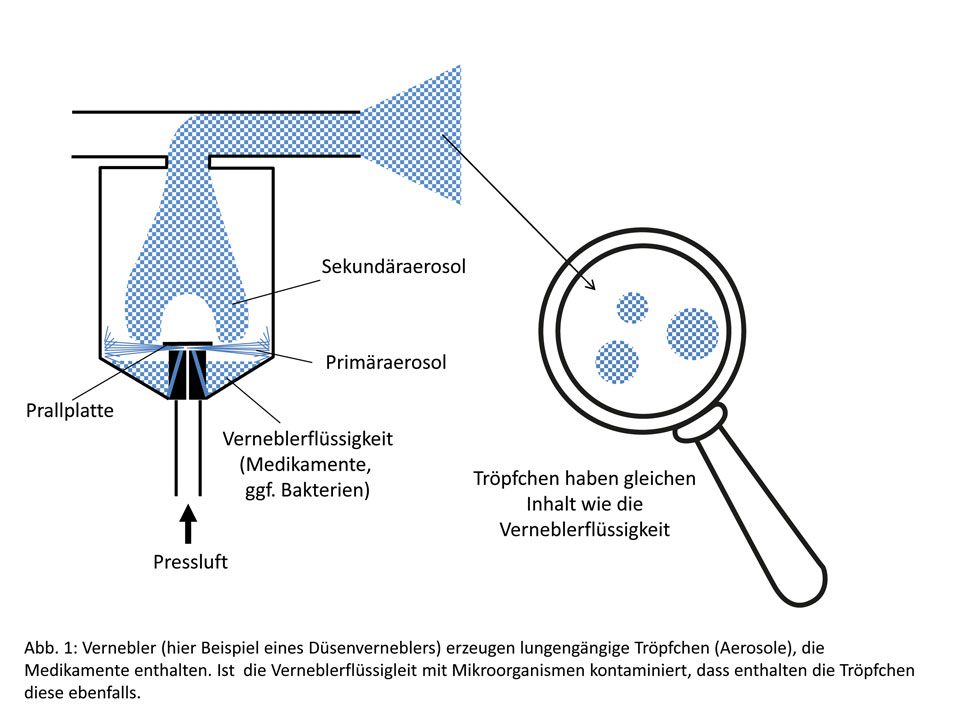
Das gilt auch für andere Systeme, wo Tröpfchen entstehen, beispielsweise beim Duschen. Hier ist ein Teil der Duschtröpfchen so klein, dass dieser eingeatmet und in die Lunge gelangen kann. Beispiel für eine Infektion ist die Legionärskrankheit, die durch Duschen übertragen werden kann, besonders dann, wenn die Rohrsysteme entsprechend lange nicht benutzt wurden und sich hohe Konzentrationen an Legionellen angesammelt haben.
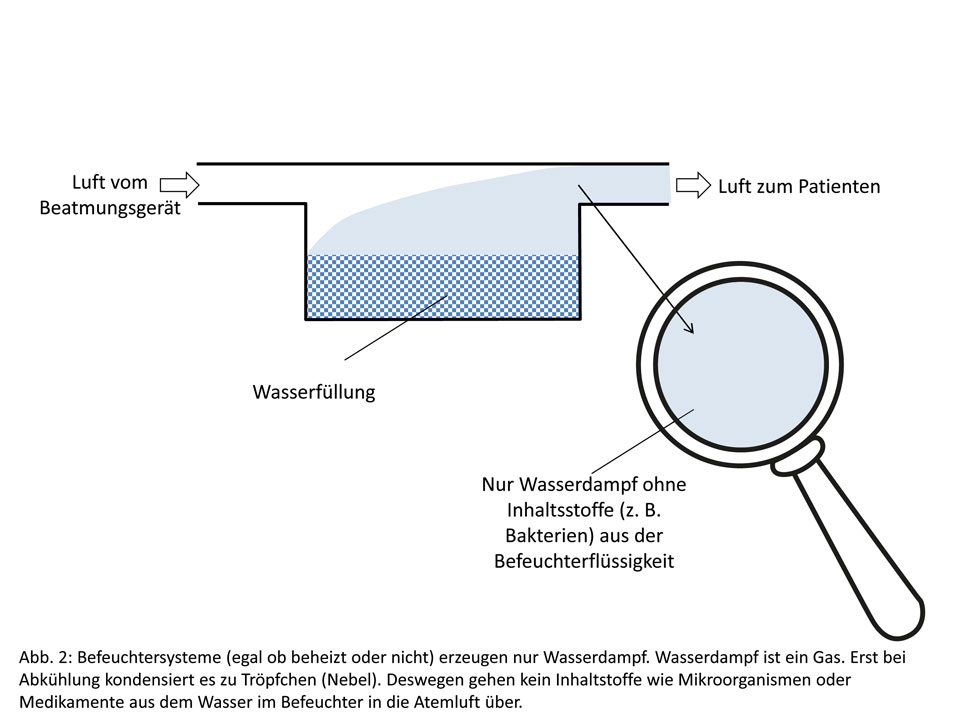
Ganz anders ist, wie erwähnt, die Situation bei den Befeuchtungsgeräten, dargestellt in Abb. 2. Hier streicht die Luft über eine Wasseroberfläche und nimmt entsprechend Wassermoleküle mit, die als Wasserdampf bzw. als „Wassergas“ mitwandern. Der Wasserdampf enthält keine Inhaltsstoffe, die im Wasser enthalten sind, also auch keine Bakterien. Mit anderen Worten, man könnte theoretisch völlig verunreinigtes Wasser benutzen, ohne dass eine Gefährdung für den Patienten entstehen würde.
Um das zu beweisen, hatten wir vor einigen Jahren eine entsprechende Studie durchgeführt (2). Die wesentlichen Ergebnisse sind in Abb. 3 dargestellt. Hier wurde das Wasser radioaktiv markiert mit 99mTc, eine in der Nuklearmedizin übliche Substanz. Die radioaktive Substanz würde sich dann so verhalten wie Bakterien. Der Fluss aus dem Beatmungsgerät wurde durch zwei bakteriendichte Filter geleitet. Auch nach Ventilation über mehrere Stunden zeigte sich keine Radioaktivität im Filter. Das bestätigt noch einmal die physikalischen Verhältnisse. Wasserdampf kann eben keine Inhaltsstoffe aus der wässrigen Lösung mitnehmen.
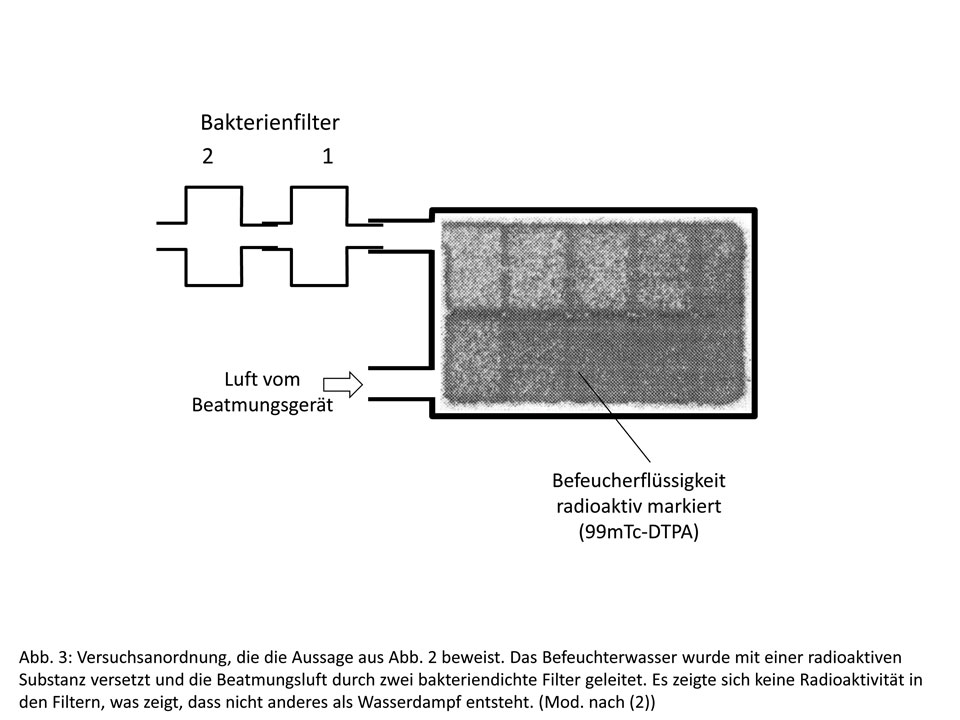
Für praktische Zwecke heißt das, dass die Befeuchtersysteme nicht mit teuerem Sterilwasser gefüllt werden müssen. Schon gar nicht mit destilliertem Wasser, wie es zum Beispiel an Tankstellen angeboten wird. Dieses ist zwar für Akkumulatoren geeignet, enthält aber häufig Bakterien (Pseudomonaden), sodass es sowieso nicht in Frage kommt. Die einfachste Lösung ist, normales Leitungswasser zu benutzen. Dieses hat allerdings gelegentlich den Nachteil, dass es – je nach Region – oft unterschiedlich viel Kalk enthält, der insbesondere bei Erwärmung ausfällt und hässliche Beläge an der Befeuchterwand bildet. Jeder kennt das von den Wasserkochern zu Hause.
Man kann diese Beläge vermeiden, wenn man etwa über 10 Minuten abgekochtes Wasser benutzt, das man auskühlen lässt. Dann ist der Kalk im Wesentlichen ausgefallen, sodass er sich nicht an der Wand des Befeuchtersystems niederschlagen kann.
Zusammenfassend ist es physikalisch eindeutig und auch in Studien bewiesen, dass Befeuchtersysteme – im Gegensatz zu Verneblern – problemlos mit Leitungswasser gefüllt werden können, welches gegebenenfalls je nach Wasserhärte vorher abgekocht werden kann. Auch bei bakterieller Kontamination des Wassers besteht keine Gefahr für den Patienten. Sterilwasser ist nicht erforderlich.
Literatur:
- Massie CA, Hart RW, Peralez K, Richards GN. Effects of humidification on nasal symptoms and compliance in sleep apnea patients using continuous positive airway pressure. Chest. 1999; 116:403-8.
- Oto J, Imanaka H, Nishimura M. Clinical factors affecting inspired gas humidification and oral dryness during noninvasive ventilation. J Crit Care. 2011; 26:535.e9-535.e15.
- Wenzel M, Klauke M, Gessenhardt F, Dellweg D, Haidl P, Schönhofer B, Köhler D. Sterile water is unnecessary in a continuous positive airway pressure convection-type humidifier in the treatment of obstructive sleep apnea syndrome. Chest. 2005; 128:2138-40.
- Wiest GH, Lehnert G, Brûck WM, Meyer M, Hahn EG, Ficker JH. A heated humidifier reduces upper airway dryness during continuous positive airway pressure therapy. Respir Med. 1999; 93:21-6.

